Mischbarkeit: Unterschied zwischen den Versionen
- Seiten mit Skriptfehlern
- Thermodynamik
- Werkstoffeigenschaft
imported>Lómelinde K (Referenzfehler wirkungslosen doppelten Inhalt für Ref-Tag entfernt) |
imported>Vfb1893 (BKL Homogenität (Begriffsklärung) aufgelöst) |
||
| Zeile 1: | Zeile 1: | ||
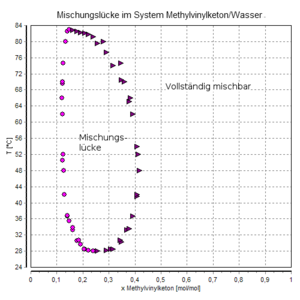
[[Datei:Mischungslücke Methylvinylketon,Wasser.png|mini|Methylvinylketon / Wasser:<br />mischbar unterhalb 28 °C und oberhalb 84 °C,<br />nicht mischbar dazwischen]] | [[Datei:Mischungslücke Methylvinylketon,Wasser.png|mini|Methylvinylketon / Wasser:<br />mischbar unterhalb 28 °C und oberhalb 84 °C,<br />nicht mischbar dazwischen]] | ||
Unter '''Mischbarkeit''' versteht man die qualitative Aussage, dass bei der Vermengung von mindestens zwei verschiedenen [[Flüssigkeit]]en sie sich vollständig unter Bildung einer einzigen [[ | Unter '''Mischbarkeit''' versteht man die qualitative Aussage, dass bei der Vermengung von mindestens zwei verschiedenen [[Flüssigkeit]]en sie sich vollständig unter Bildung einer einzigen [[Homogenität|homogenen]] [[Phase (Materie)|Phase]] [[Mischen (Verfahrenstechnik)|mischen]]. | ||
Zum Beispiel lassen sich [[Wasser]] und niedere [[Alkohole]] in jedem Verhältnis mischen, Wasser und [[Benzol]] bilden hingegen zwei Phasen, eine wasserreiche und eine benzolreiche. Auch in der benzolreichen Phase ist allerdings Wasser enthalten (ca. 0,25 [[Molprozent]] bei 25 °C<ref name="Griswold">J. Griswold, J.N. Chew, M.E. Klecka: <!--Titel des Artikels fehlt--> In: ''Ind. Eng. Chem.'' 42(6), 1950.</ref>) und in der wasserreichen etwas Benzol (0,04 Molprozent bei 25 °C<ref name="Griswold" />). Damit kann selbst dieses System in sehr begrenztem Umfang als mischbar betrachtet werden. | Zum Beispiel lassen sich [[Wasser]] und niedere [[Alkohole]] in jedem Verhältnis mischen, Wasser und [[Benzol]] bilden hingegen zwei Phasen, eine wasserreiche und eine benzolreiche. Auch in der benzolreichen Phase ist allerdings Wasser enthalten (ca. 0,25 [[Molprozent]] bei 25 °C<ref name="Griswold">J. Griswold, J.N. Chew, M.E. Klecka: <!--Titel des Artikels fehlt--> In: ''Ind. Eng. Chem.'' 42(6), 1950.</ref>) und in der wasserreichen etwas Benzol (0,04 Molprozent bei 25 °C<ref name="Griswold" />). Damit kann selbst dieses System in sehr begrenztem Umfang als mischbar betrachtet werden. | ||
| Zeile 9: | Zeile 9: | ||
Über die Mischbarkeit verschiedener Flüssigkeiten gibt eine Mischbarkeitstabelle Aufschluss. | Über die Mischbarkeit verschiedener Flüssigkeiten gibt eine Mischbarkeitstabelle Aufschluss. | ||
Ist ein Stoff nicht mit Wasser mischbar, so ist ein möglicher Grund der [[Hydrophober Effekt|hydrophobe Effekt]]. | |||
== Siehe auch == | == Siehe auch == | ||
| Zeile 16: | Zeile 18: | ||
== Weblinks == | == Weblinks == | ||
{{Commonscat|Immiscible liquids}} | {{Commonscat|Immiscible liquids}} | ||
*[ | * [https://www.erowid.org/archive/rhodium/pdf/solvent.miscibility.pdf Mischbarkeitstabelle] (PDF; 236 kB) | ||
== Einzelnachweise == | == Einzelnachweise == | ||
Aktuelle Version vom 12. Juli 2021, 19:30 Uhr
Unter Mischbarkeit versteht man die qualitative Aussage, dass bei der Vermengung von mindestens zwei verschiedenen Flüssigkeiten sie sich vollständig unter Bildung einer einzigen homogenen Phase mischen.
Zum Beispiel lassen sich Wasser und niedere Alkohole in jedem Verhältnis mischen, Wasser und Benzol bilden hingegen zwei Phasen, eine wasserreiche und eine benzolreiche. Auch in der benzolreichen Phase ist allerdings Wasser enthalten (ca. 0,25 Molprozent bei 25 °C[1]) und in der wasserreichen etwas Benzol (0,04 Molprozent bei 25 °C[1]). Damit kann selbst dieses System in sehr begrenztem Umfang als mischbar betrachtet werden.
Die Mischbarkeit hängt bei einigen Stoffgemischen deutlich von der Temperatur ab. Ein Beispiel dafür ist das Gemisch aus Methylvinylketon (3-Buten-2-on) und Wasser, das unterhalb 28 °C und oberhalb 84 °C mischbar ist, jedoch nicht zwischen diesen Grenzen (Mischungslücke, vgl. Abbildung).
Einen großen Einfluss auf die Mischbarkeit zweier Flüssigkeiten hat ihre Polarität; so lassen sich vor allem Flüssigkeiten miteinander mischen, deren Polarität zueinander passt.
Über die Mischbarkeit verschiedener Flüssigkeiten gibt eine Mischbarkeitstabelle Aufschluss.
Ist ein Stoff nicht mit Wasser mischbar, so ist ein möglicher Grund der hydrophobe Effekt.
Siehe auch
- Löslichkeit
- Massenanteil
Weblinks
- Mischbarkeitstabelle (PDF; 236 kB)