Im Inneren des Atoms
Ein einfaches Atommodell
Alle Materie im Universum besteht aus Atomen. Atome sind viel zu klein, um mit einem gewöhnlichen Mikroskop betrachtet zu werden - es gibt mehr als eine Milliarde von ihnen auf der Oberfläche dieses Satzpunktes. Indem Wissenschaftler wie Ernest Rutherford jedoch winzige atomare Teilchen durch Atome schossen, konnten sie Modelle (Beschreibungen) ihrer Struktur entwickeln. In fortgeschrittenen Arbeiten verwenden Wissenschaftler ein mathematisches Modell des Atoms. Das folgende einfache Modell wird jedoch häufig verwendet, um die grundlegende Vorstellung von einem Atom zu erklären.
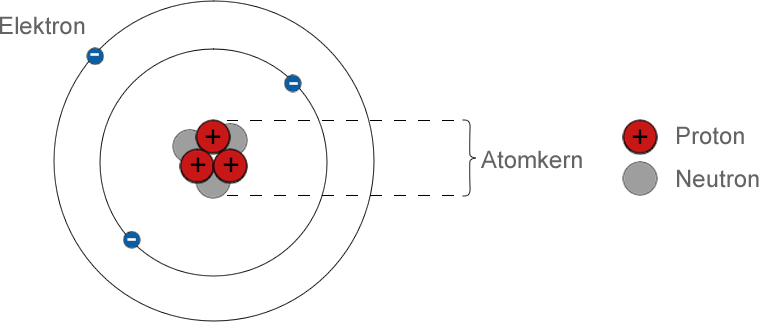
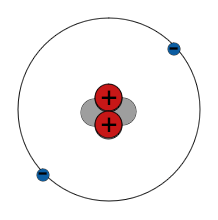
Ein Atom besteht aus kleineren Teilchen
- Es gibt einen zentralen Atomkern aus Protonen und Neutronen. Um diese herum bewegen sich Elektronen mit hoher Geschwindigkeit. Die Anzahl der Teilchen in einem Atom hängt von der Art des Atoms ab.
- Protonen haben eine positive (+) elektrische Ladung. Elektronen haben eine negative (-) elektrische Ladung. Normalerweise hat ein Atom die gleiche Anzahl von Elektronen und Protonen, also ist seine Gesamtladung Null.
- Protonen und Neutronen heißen Nukleonen und jedes ist etwa 1800 Mal massereicher als ein Elektron, so dass sich praktisch die gesamte Masse eines Atoms in seinem Kern befindet.
- Elektronen werden durch die Anziehungskraft zwischen entgegengesetzten Ladungen in der Umlaufbahn um den Atomkern gehalten. Protonen und Neutronen sind im Kern durch eine andere Art von Kraft, der sogenannten starken Kernkraft, eng miteinander verbunden.
Über Ladungen
Es gibt zwei Arten von elektrischer Ladung: positiv (+) und negativ (-). Gleiche Ladungen stoßen sich ab, ungleiche Ladungen ziehen sich an.
Elemente und Ordnungszahlen
Alle Materie besteht aus rund 100 Grundbausteinen, den Elementen. Ein Atom ist das kleinste "Stück" eines Elements, das du haben kannst. Jedes Element hat eine unterschiedliche Anzahl von Protonen in seinem Atomkern: Es hat eine andere Ordnungszahl (manchmal auch Protonenzahl genannt). Die Ordnungszahl gibt auch die Anzahl der Elektronen im Atom an (siehe Tabelle).
| Element | Chemisches Symbol | Ordnungs-zahl |
|---|---|---|
| Wasserstoff | H | 1 |
| Helium | He | 2 |
| Lithium | Li | 3 |
| Beryllium | Be | 4 |
| Bor | B | 5 |
| Kohlenstoff | C | 6 |
| Stickstoff | N | 7 |
| Sauerstoff | O | 8 |
| ↓ | ||
| Radium | Ra | 88 |
| Thorium | Th | 90 |
| Uran | U | 92 |
| Plutonium | Pu | 94 |
| ↓ |
Isotope und Massenzahl
Die Atome eines Elements sind nicht alle genau gleich. Einige haben vielleicht mehr Neutronen als andere. Diese verschiedenen Versionen eines Elements heißen Isotope. Sie haben identische chemische Eigenschaften, obwohl ihre Atome unterschiedliche Massen haben. Die meisten Elemente sind eine Mischung von zwei oder mehr Isotopen. In der Tabelle weiter unten werden einige Beispiele gezeigt.
$ \mathrm { \begin{array}{lll} \mathsf {\scriptsize Massenzahl} \\ \; \diagdown \\ \mathrm {\ \ \ \ \ ^7_3 Li} \ \ \\ \; \diagup \\ \mathsf {\scriptsize Ordnungszahl} \end{array} }$
Die Gesamtzahl der Protonen und Neutronen im Atomkern wird als Massenzahl (oder Nukleonenzahl) bezeichnet. Isotope haben die gleiche Ordnungszahl, aber unterschiedliche Massenzahlen. Zum Beispiel ist das Metall Lithium (Ordnungszahl 3) ein Gemisch aus zwei Isotopen mit den Massenzahlen 6 und 7. Lithium-7 ist das üblichere: Über 93% der Lithiumatome sind von diesem Typ. Im gelben Kasten kannst du sehen, wie ein Lithium-7 Atom mit einem Symbol und Zahlen dargestellt wird.
| Isotop
e = Elektron (-)
p = Proton (+) n = Neutron |
||||||
|---|---|---|---|---|---|---|
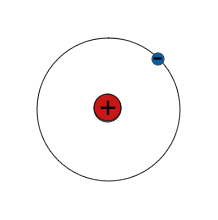
| H |
|
1 e | > 99 % |
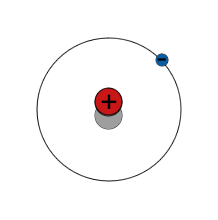
|
1 e | < 1 % |
| 1 p 0 n Wasserstoff-1 |
$\mathsf{^1_1 H}$ | 1 p 1 n Wasserstoff-2 |
$\mathsf{^2_1 H}$ | |||
| He |
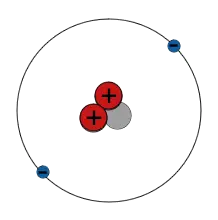
|
2 e | < 1 % |
|
2 e | > 99 % |
| 2 p 1 n Helium-3 |
$\mathsf{^3_2 He}$ | 2 p 2 n Helium-4 |
$\mathsf{^4_2 He}$ | |||
| Li |
|
3 e | 7 % |
|
3 e | 93 % |
| 3 p 3 n Lithium-6 |
$\mathsf{^6_3 Li}$ | 3 p 4 n Lithium-7 |
$\mathsf{^7_3 Li}$ | |||
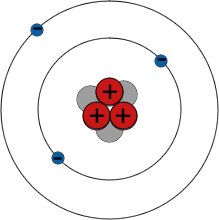
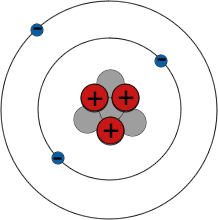
Elektronenschalen
Das Periodensystem fasst alle Elemente nach ihren chemischen Eigenschaften zusammen. Zum Beispiel sind alle Elemente der Gruppe I hoch reaktive Metalle - und alle haben ein einzelnes Elektron in ihrer äußeren Schale.
Elektronen umkreisen den Atomkern nur auf festgelegten Bahnen. Diese Bahnen werden als Schalen bezeichnet. Elektronen besetzen normalerweise Schalen so nahe wie möglich am Atomkern, aber es gibt eine Grenze dafür, wie viele Elektronen jede Schale aufnehmen kann - zum Beispiel nicht mehr als 2 Elektronen in der ersten Schale und 8 in der zweiten Schale. Es sind die äußersten Elektronen eines Atoms, die die chemischen Bindungen mit anderen Atomen bilden, also haben Elemente mit ähnlichen Elektronenanordnungen ähnliche chemische Eigenschaften.
Fragen
Für die Fragen 4 und 5 benötigst Du die Daten aus der obigen Tabelle.
Richtig ist:
- Elektronen
- Neutronen
- Elektronen
- Protonen und Neutronen
- Elektronen
Richtig ist:
- 13
- 13
- 14
Richtig ist:
Richtig ist:
- $\mathrm{^{12}_{\ \ 6}C}$
- $\mathrm{^{16}_{\ \ 8}O}$
- $\mathrm{^{226}_{\ \ 88}Ra}$
Richtig ist:
- Kohlenstoff-12
- Kohlenstoff-14
- Stickstoff