Radioaktiver Zerfall (1)
Wissenswertes in der Kernphysik
Elemente existieren in verschiedenen Versionen, Isotope genannt. Zum Beispiel gibt es von Lithium zwei Isotope: Lithium-6 (mit 3 Protonen und 3 Neutronen im Atomkern) und Lithium-7 (mit 3 Protonen und 4 Neutronen).
Jeder einzelne Atomtyp, beispielsweise Lithium-7, wird als Nuklid bezeichnet. Anstelle von Nuklid wird jedoch üblicherweise das Wort "Isotop" verwendet.
Radioaktive Isotope haben einen instabilen Atomkern. Mit der Zeit zerfällt der Atomkern, indem er ein Alpha- oder Beta-Teilchen und in einigen Fällen auch Gammastrahlung emittiert.
Das für die Darstellung von Atomen verwendete Symbolsystem kann auch für Atomkerne und andere Teilchen verwendet werden.
| Atomkern Beispiel Helium |
Alpha Teilchen
Helium-Kern 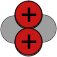
|
Beta Teilchen
Elektron 
|
|---|---|---|
|
$ \begin{array}{lll} \mathsf{\scriptsize Massenzahl:}\newline \mathsf{\scriptsize Anzahl \ Nukleonen} \\ \mathsf{\scriptsize (Protonen+Neutronen) \ im \ Kern}\\ \;\;\; \diagdown \\ \;\; \mathrm {\ \ \ \ \ ^4_2 He} \ \ \\ \;\;\; \diagup \\ \mathsf {\scriptsize Ordnungszahl:}\\ \mathsf {\scriptsize auch \ die \ relative \ Ladung \ im \ Kern}\\ \mathsf {\scriptsize verglichen \ mit \ +1 \ für \ ein \ Proton} \end{array} $ |
$ \mathrm { \begin{array}{lll} \mathsf {\scriptsize 4 \ Nukleonen} \\ \;\;\; \diagdown \\ \;\; \mathrm {\ \ \ \ \ ^4_2 \alpha \ \ oder \ \ ^4_2 He} \\ \;\;\; \diagup \\ \mathsf {\scriptsize relative \ Ladung \ +2} \end{array} }$ |
$ \mathrm { \begin{array}{lll} \mathsf {\scriptsize Masse \ unwesentlich, \ verglichen}\\ \mathsf {\scriptsize mit \ einem \ Proton \ oder \ Neutron} \\ \;\;\; \diagdown \\ \mathrm {\ \ \ \ \ ^{\ \ \ 0}_{-1} \beta \ \ oder \ \ ^{\ \ \ 0}_{-1}e} \ \ \\ \;\;\; \; \diagup \\ \mathsf {\scriptsize relative \ Ladung \ gleich,}\\ \mathsf {\scriptsize aber \ entgegengesetzt \ zu}\\ \mathsf {\scriptsize der \ eines \ Protons} \end{array} }$ |
Wenn ein Isotop radioaktiv ist, hat es in seinem Atomkern eine instabile Anordnung von Neutronen und Protonen. Die Emission eines Alpha- oder Beta-Teilchens macht den Atomkern zwar stabiler, verändert aber die Anzahl der darin enthaltenen Protonen und Neutronen. So wird er zum Atomkern eines anderen Elements, den man Tochterkern nennt. Der Tochterkern und alle emittierten Teilchen sind die Zerfallsprodukte.
Alpha-Zerfall
Radium-226 (Ordnungszahl 88) zerfällt durch Alpha-Emission. Durch den Verlust des Alpha-Teilchens hat der Atomkern nun 2 Protonen und 2 Neutronen weniger als zuvor. Also sinkt die Massenzahl auf 222 und die Ordnungszahl auf 86. Laut Periodensystem hat das Element Radon eine Ordnungszahl von 86, also ist Radon das neue entstandene Element:
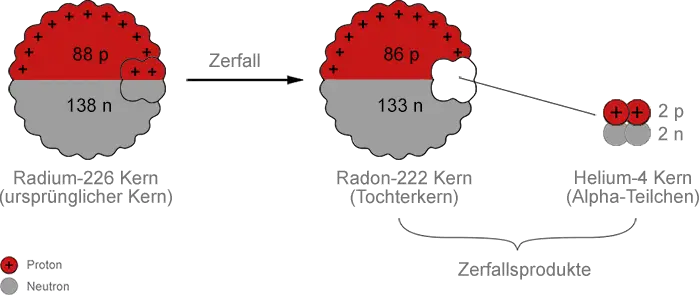
Der Zerfallsprozess kann als Gleichung dargestellt werden:
$\mathrm {^{226}_{\ 88} Ra \ \longrightarrow \ ^{226}_{\ 86} Rn \ + \ ^4_2 \alpha}$
Beim Alpha-Zerfall ... :
- ist die Massenzahl (oben) auf beiden Seiten der Gleichung ausgeglichen
(226 = 222 + 4), so dass die Zahl der Nukleonen unverändert (erhalten) bleibt - ist die Ordnungszahl (unten) auf beiden Seiten der Gleichung ausgeglichen
(88 = 86 + 2), so dass die Ladung erhalten bleibt - ist ein neues Element entstanden: Ordnungszahl 2 weniger als vorher, Massenzahl 4 weniger als vorher.
Beta-Zerfall
Iod-131 (Ordnungszahl 53) zerfällt durch Beta-Emission. Wenn dies geschieht, wandelt sich ein Neutron in ein Proton, ein Elektron und einen ungeladenen, fast masselosen Verwandten des Elektrons, ein Antineutrino um. Das Elektron und das Antineutrino verlassen den Atomkern mit hoher Geschwindigkeit. Da im Atomkern ein Neutron durch ein Proton ersetzt wurde, steigt die Ordnungszahl auf 54. Dies bedeutet, dass ein Atomkern von Xenon-131 entstanden ist:
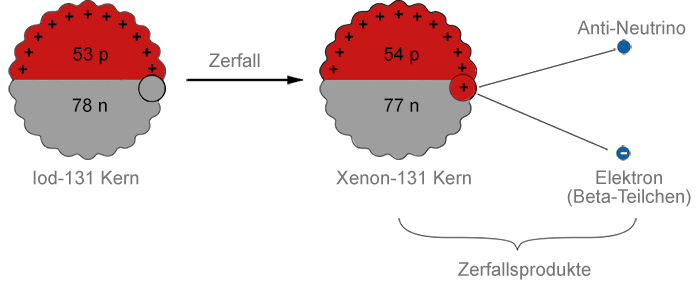
Der Zerfallsprozess kann als Gleichung dargestellt werden:
$\mathrm {^{131}_{\ \ 53} I \ \longrightarrow \ ^{131}_{\ \ 54} Xe \ + \ ^{\ \ \ 0}_{-1} \beta \ + \ \overline v} \;\;\; \mathsf {\scriptsize (\overline v \ = \ Antineutrino)}$
Bei dieser Art des Beta-Zerfalls ... :
- ist die Massenzahl (oben) auf beiden Seiten der Gleichung ausgeglichen
(131 = 131 + 0 + 0), so dass die Zahl der Nukleonen unverändert (erhalten) bleibt - ist die Ordnungszahl (unten) auf beiden Seiten der Gleichung ausgeglichen
(53 = 54-1 + 0), so dass die Ladung erhalten bleibt - entsteht ein neues Element: Ordnungszahl 1 mehr als vorher, Massenzahl unverändert.
Beta$^-$ und Beta$^+$
Es gibt eine weniger häufige Form des Beta-Zerfalls, bei der das emittierte Betateilchen ein Positron ist. Dies ist das Antiteilchen des Elektrons mit derselben Masse, aber entgegengesetzter Ladung (+1). Während dieser Art von Zerfall wandelt sich ein Proton in ein Neutron, ein Positron und ein Neutrino um. Das gebildete Element hat eine Ordnungszahl um eins weniger als zuvor.
Um die beiden Arten des Beta-Zerfalls zu unterscheiden, werden sie manchmal als Beta$^-$ -Zerfall (Elektronen-Emission) und Beta$^+$ -Zerfall (Positronen-Emission) bezeichnet.
Gammaemission
Bei einigen Isotopen hinterlässt die Emission eines Alpha- oder Betateilchens die Protonen und Neutronen in einer "angeregten" Anordnung. Wenn sich die Protonen und Neutronen neu ordnen, um stabiler zu werden, geben sie Energie ab. Diese wird als Gammastrahlung emittiert.
- Die Emission von Gammastrahlen selbst bewirkt keine Änderung der Massenzahl oder der Ordnungszahl.
Fragen
Richtig ist:
- Alphastrahlung
- A = 228, Z = 88
- Es entsteht Radium
- $\mathrm {^{232}_{\ 90} Th \ \longrightarrow \ ^{228}_{\ 88} Ra \ + \ ^4_2 \alpha}$
- Radium-Isotop und Alpha-Teilchen
Richtig ist:
- 0
- -1
- Elektron (Beta-Teilchen)