Cluster (Physik)
- Seiten mit Skriptfehlern
- Molekülphysik

C540 ist aufgrund seiner enormen Größe eine sehr labile sphärische Struktur, weil sie eben nur sphärisch ist. Solche großen Fullerene sind daher nur in Verbindung mit C60, C70 und größeren Fullerenen als sogenannte „Onions“ stabil.
Unter einem Cluster versteht man eine Ansammlung von Atomen oder Molekülen, deren Atomanzahl $ n $ zwischen 3 und 10 Millionen liegt.
Aufgrund ihrer geringen Größe haben Cluster Eigenschaften, die von denen eines makroskopischen Festkörpers abweichen. Konzepte aus der Atom- und Molekülphysik versagen oft, wenn es um die Erklärung von Eigenschaften solch kleiner Partikel geht. Die Eigenschaften der Cluster stellen also ein Bindeglied zwischen Atom- und Molekülphysik auf der einen, und der Festkörperphysik auf der anderen Seite dar. Gegenstand der Forschung in diesem Gebiet ist, wie sich aus den Eigenschaften eines Atoms oder Moleküls die makroskopischen Eigenschaften eines Festkörpers entwickeln. Für viele Eigenschaften des Clusters ist das Verhältnis von Oberflächen- zu Volumenatomen entscheidend.
Man unterscheidet des Weiteren einen freien Cluster von einem deponierten Cluster. Letzterer befindet sich auf einer Oberfläche, während der freie Cluster sich frei im Raum bewegt.
Einteilung
Generell werden die Cluster nach Anzahl der Atome (n) eingeteilt:
- n = 3–12 Atome (Mikrocluster): Für Mikrocluster sind noch alle Bestandteile des Clusters an der Oberfläche. Konzepte und Methoden der Atom- und Molekülphysik und der Oberflächenphysik sind anwendbar und brauchbar.
- n = 13–100 Atome (kleine Cluster): Die Eigenschaften kleiner Cluster werden entscheidend von Quanteneffekten bestimmt. Die elektronischen Energieniveaus liegen zwar schon recht nahe beieinander, aber für eine Bänderstruktur wie im Festkörper ist die Anzahl der Atome noch zu gering. Der Einbau eines zusätzlichen Atoms oder Moleküls kann noch sehr viel ändern. Oft existieren viele isomere Clusterstrukturen mit nahe beieinander liegenden Energieniveaus. Molekulare Konzepte verlieren ihre Brauchbarkeit. Auch hier spielt die Oberflächenphysik, wegen des großen Verhältnisses der Oberflächenatome zu Volumenatomen des Clusters, noch eine sehr wichtige Rolle.
- n = 100–1000 Atome (große Cluster): Man beobachtet einen graduellen Übergang zu den Eigenschaften des Festkörpers, wie etwa Übergänge bei Kristallgittern (Chrom hat beispielsweise bei ungefähr n = 490 einen Übergang von fcc (< 490) zu bcc (> 490); diese Werte haben eine Schwankungsbreite von 100 Atomen).
- n > 1000 Atome (kleine Teilchen bzw. Nanokristalle)
Einige, aber noch nicht alle Festkörpereigenschaften haben sich entwickelt. Ab ungefähr 50.000 Atome haben sich die Eigenschaften nun so stark entwickelt, dass man ab dann von einem Festkörper spricht.[1]
Klassifikation nach der chemischen Bindung
- metallische Cluster: halbvolles Band delokalisierter Elektronen, Beispiele: Alkalimetallcluster, Al-, Cu-, Fe-, Pt-, W-, Hg-Cluster; jeweils mit n > 200 Atome, mittlere Bindungsenergie: 0,5–3 eV
- kovalente Cluster: durch sp-Hybridisierung ausgerichtete Bindung durch Elektronenpaare; Beispiele: C-Cluster (bekanntestes Beispiel sind die Fullerene, siehe auch das Bild oben. Kohlenstoffnanoröhren und Diamantcluster gehören ebenfalls zu den Kohlenstoff-Clustern); Si-, Hg-Cluster; jeweils mit 30 < n < 80 Atomen, mittlere Bindungsenergie: 1–4 eV, Hg ≈ 0,5 eV
- ionische Cluster: Bindung durch Coulomb-Kräfte zwischen Ionen, Beispiele: (KF)-, (CaI2)-Cluster, mittlere Bindungsenergie: 2–4 eV
- Cluster mit Wasserstoffbrückenbindung: starke Dipol-Dipol-Anziehung, Beispiele: (HF)-, (H2O)-Cluster, mittlere Bindungsenergie: 0,15–0,5 eV
- molekulare Cluster: Van-der-Waals-Cluster, plus schwache kovalente Anteile, Beispiele: (I2)-, (As4)-, (S8)-, organische Molekülcluster, mittlere Bindungsenergie: 0,3–1 eV
- Van-der-Waals-Cluster: induzierte Dipol-Wechselwirkung zwischen Atomen und Molekülen mit abgeschlossener elektronischer Schale, Beispiele: Edelgas-, (H2)-, (CO2)-, Hg-Cluster; jeweils mit n < 10 Atome, mittlere Bindungsenergie: 0,001–0,3 eV
Struktur freier Cluster
Von herausragender Bedeutung für die Struktur von freien Clustern ist die Regel von Friedel:
- Diejenige Clusterstruktur mit der größten Anzahl von Nächste-Nachbarn-Bindungen besitzt die größte Bindungsenergie und ist daher die stabilste von allen möglichen Strukturen.
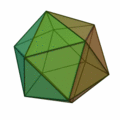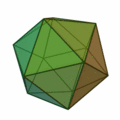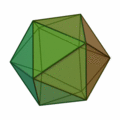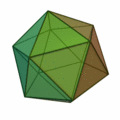
Aus dieser Regel ergeben sich meist Strukturen nach dem Muster der Platonischen Körper:
Besonders wichtig ist hier die Struktur des Ikosaeders (Struktur ganz rechts), welche für Cluster mit einer Atomzahl von n > 12 besonders häufig vorkommt. In jeder Ecke des Körpers und im Innern der Ikosaederstruktur ist ein Atom platziert. Aufgrund der 12 Ecken gibt es also für einen 13-atomigen Cluster 12 Oberflächenatome und 1 Volumenatom. Für größere Atomzahlen wird eine neue Schale mit Atomen nach ikosaedrischer Form aufgefüllt, wobei wegen der größeren Bindungslänge in der k-ten Schale 10k²+2 Atome in der Schale Platz finden. Somit gibt es also für die erste Schale 12 Atome, für die zweite Schale gibt es Platz für genau 42 weitere Atome, für die dritte Schale 92 Atome usw. Bei allen diesen Schalen befinden sich wie bei der k = 1 Schale 12 Atome auf den Ecken eines Ikosaeders und zusätzlich 10k²−10 Atome auf den Flächen. Diese konzentrischen Ikosaeder muss man sich dann wie Matroschkas vorstellen, auf deren Oberfläche sich die Atome befinden. Wie in der Atomphysik mit den stabilen Edelgasatomen gibt es auch sehr stabile Cluster aufgrund der Schalenabschlüsse. Eine abgeschlossene Clusterschalenstruktur ergibt sich nur für wenige Clustergrößen: n = 13, n = 55, n = 147, n = 309, n = 561, n = 923 und n = 1415; sie werden als „Magische Zahlen“ bezeichnet. Gemeinhin werden diese sehr stabilen Cluster mit gefüllten Atomschalen auch Mackaysche Ikosaeder genannt. Die Platonischen Körper der obigen Abbildung treten bei den Mikroclustern auf, der Hexaeder auch bei größeren Clustern.[2]
Die magischen Clusterzahlen lassen sich nach folgender Formel berechnen:
- $ C=\,{\frac {10n^{3}-15n^{2}+11n-3}{3}} $
- $ C $ = Gesamtzahl der Atome
- $ n $ = Anzahl der Atome pro Kante
Literatur
Einführende Literatur
- H. Haberland: Lehrbuch der Experimentalphysik: Lehrbuch der Experimentalphysik 5. Gase, Nanosysteme, Flüssigkeiten: Gase, Nanosysteme, Flussigkeiten. Kapitel Cluster. Hrsg.: Ludwig Bergmann, Clemens Schaefer, Karl Kleinermanns. 2. Auflage. Gruyter, 2005, ISBN 3-11-017484-7.
- Viktor Gutmann, Edwin Hengge: Anorganische Chemie. Eine Einführung. 5. Auflage. Wiley-VCH, 1990, ISBN 3-527-28159-2 (Kapitel Cluster).
Wichtige Veröffentlichungen
- A. L. Mackay: A dense non-crystallographic packing of equal spheres. In: Acta Crystallographica. Band 15, Nr. 9, 1962, S. 916–918, doi:10.1107/S0365110X6200239X (Mackaysche Ikosaeder).
- Jortner, Joshua: Level structure and dynamics of clusters. In: Berichte der Bunsengesellschaft für physikalische Chemie. Band 88, 1984, S. 188–201.
Einzelnachweise
- ↑ Oliver Rattunde;Hellmut Haberland: Clusterphysik. Abgerufen am 19. Januar 2017.
- ↑ Helmut Haberland, Karl Kleinermanns, Frank Träger: Bergmann-Schaefer - Experimentalphysik Band 5 - Gase, Nanosysteme, Flüssigkeiten - Kapitel 9 Cluster. Band 5. Walter de Gruyter, 2006, ISBN 978-3-11-017484-7, S. 817 ff.