Kugelwolkenmodell: Unterschied zwischen den Versionen
imported>Kein Einstein (Durchgang) |
imported>Johannnes89 K (Änderungen von 2A02:3032:3:C36A:1D09:5AE0:AC09:5415 (Diskussion) rückgängig gemacht (HG) (3.4.10)) |
||
| Zeile 1: | Zeile 1: | ||
{{Belege fehlen}} | {{Belege fehlen}} | ||
Das '''Kugelwolkenmodell''' (KWM, | Das '''Kugelwolkenmodell''' ('''KWM''', auch '''Kimballsches Atommodell''' und '''Tetraedermodell''') ist ein [[Atommodell]], mit dem sich manche Phänomene – wie beispielsweise die [[kovalente Bindung]] oder der [[Molekül]]bau – veranschaulichen lassen. Es stellt eine Erweiterung des [[Bohrsches Atommodell|Bohrschen Atommodells]] dar und ist eine Vereinfachung gegenüber dem genaueren [[Orbitalmodell]]. Das Modell geht unter anderem auf den amerikanischen Quantenchemiker [[George Elbert Kimball]] (1906–1967) zurück. | ||
Aus dem [[Schalenmodell (Atomphysik)|Schalenmodell]] von [[Niels Bohr|Bohr]] übernommen sind die [[Elektronenschale]]n, die um den [[Atomkern]] angeordnet sind. In jeder Schale sind aufgrund des [[Pauli-Prinzip]]s jeweils maximal zwei [[Elektron]]en in einer Kugelwolke (kugeligen [[Elektronenwolke]]) zusammengefasst. Die Elektronenwolke ist als „Aufenthaltsraum“ für die Elektronen zu verstehen, in dem sie sich bewegen. | Aus dem [[Schalenmodell (Atomphysik)|Schalenmodell]] von [[Niels Bohr|Bohr]] übernommen sind die [[Elektronenschale]]n, die um den [[Atomkern]] angeordnet sind. In jeder Schale sind aufgrund des [[Pauli-Prinzip]]s jeweils maximal zwei [[Elektron]]en in einer Kugelwolke (kugeligen [[Elektronenwolke]]) zusammengefasst. Die Elektronenwolke ist als „Aufenthaltsraum“ für die Elektronen zu verstehen, in dem sie sich bewegen. | ||
Je weiter eine Elektronenschale vom Mittelpunkt des Atoms entfernt ist, desto mehr Elektronenwolken können geometrisch um den Kern angeordnet werden. Dementsprechend passen bei wachsender Entfernung immer mehr Elektronenwolken auf eine Schale: | Je weiter eine Elektronenschale vom Mittelpunkt des Atoms entfernt ist, desto mehr Elektronenwolken können geometrisch um den Kern angeordnet werden. Dementsprechend passen bei wachsender Entfernung immer mehr Elektronenwolken auf eine Schale: | ||
* Erste Schale (K-Schale) = 2 Elektronen = 1 Elektronenwolke | * Erste Schale (K-Schale) = 2 Elektronen = 1 Elektronenwolke | ||
| Zeile 8: | Zeile 9: | ||
* Dritte Schale (M-Schale) = 18 Elektronen = 9 Elektronenwolken | * Dritte Schale (M-Schale) = 18 Elektronen = 9 Elektronenwolken | ||
* Vierte Schale (N-Schale) = 32 Elektronen = 16 Elektronenwolken | * Vierte Schale (N-Schale) = 32 Elektronen = 16 Elektronenwolken | ||
Die Anzahl Elektronen, die in der ''n-''ten Schale Platz haben, berechnen sich nach der Formel | Die Anzahl Elektronen, die in der ''n-''ten Schale Platz haben, berechnen sich nach der Formel | ||
:Maximale Elektronenanzahl = 2•n<sup>2</sup>. | :Maximale Elektronenanzahl = 2•n<sup>2</sup>. | ||
| Zeile 18: | Zeile 20: | ||
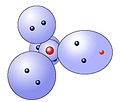
* Die Elektronenwolken versuchen immer einen möglichst großen Abstand zu erreichen, weshalb sie [[Tetraeder|tetraedrisch]] angeordnet sind. | * Die Elektronenwolken versuchen immer einen möglichst großen Abstand zu erreichen, weshalb sie [[Tetraeder|tetraedrisch]] angeordnet sind. | ||
* Die Besetzung der inneren Schalen wird nicht beachtet, da sie bei der chemischen Bindung keine Rolle spielen.<ref>''Elemente Chemie I – Baden-Württemberg'', 2004, S. 162–165.</ref> | * Die Besetzung der inneren Schalen wird nicht beachtet, da sie bei der chemischen Bindung keine Rolle spielen.<ref>''Elemente Chemie I – Baden-Württemberg'', 2004, S. 162–165.</ref> | ||
*Die weitere Besetzung der Elektronenwolken und Schalen erfolgt nach dem [[Aufbauprinzip#Das Madelung-Energieschema|Madelung-Energieschema]]. | |||
== Beispiele == | == Beispiele == | ||
| Zeile 30: | Zeile 33: | ||
== Weblinks == | == Weblinks == | ||
{{Commons|Category:Kugelwolkenmodell}} | {{Commons|Category:Kugelwolkenmodell}} | ||
* [http://www.schule-bw.de/ | * [http://www.schule-bw.de/faecher-und-schularten/mathematisch-naturwissenschaftliche-faecher/chemie/neuer-index.html/mat-seki/stoffe-teilchen/kugelwolken kurze Einführung] auf dem [[Landesbildungsserver Baden-Württemberg|Landesbildungsserver BW]] | ||
* [http://www.chemsoft.ch/kimbsite/index.html Weiterführende Betrachtungen und Visualisierungen zum quantitativen Lewis-Modell, das auf Kimballs Kugelwolken basiert] von Ernst Schumacher (englisch) | |||
== Einzelnachweise == | == Einzelnachweise == | ||
| Zeile 36: | Zeile 40: | ||
[[Kategorie:Atomphysik]] | [[Kategorie:Atomphysik]] | ||
[[Kategorie:Chemie]] | [[Kategorie:Physikalische Chemie]] | ||
Aktuelle Version vom 5. Oktober 2021, 11:37 Uhr
Das Kugelwolkenmodell (KWM, auch Kimballsches Atommodell und Tetraedermodell) ist ein Atommodell, mit dem sich manche Phänomene – wie beispielsweise die kovalente Bindung oder der Molekülbau – veranschaulichen lassen. Es stellt eine Erweiterung des Bohrschen Atommodells dar und ist eine Vereinfachung gegenüber dem genaueren Orbitalmodell. Das Modell geht unter anderem auf den amerikanischen Quantenchemiker George Elbert Kimball (1906–1967) zurück.
Aus dem Schalenmodell von Bohr übernommen sind die Elektronenschalen, die um den Atomkern angeordnet sind. In jeder Schale sind aufgrund des Pauli-Prinzips jeweils maximal zwei Elektronen in einer Kugelwolke (kugeligen Elektronenwolke) zusammengefasst. Die Elektronenwolke ist als „Aufenthaltsraum“ für die Elektronen zu verstehen, in dem sie sich bewegen.
Je weiter eine Elektronenschale vom Mittelpunkt des Atoms entfernt ist, desto mehr Elektronenwolken können geometrisch um den Kern angeordnet werden. Dementsprechend passen bei wachsender Entfernung immer mehr Elektronenwolken auf eine Schale:
- Erste Schale (K-Schale) = 2 Elektronen = 1 Elektronenwolke
- Zweite Schale (L-Schale) = 8 Elektronen = 4 Elektronenwolken
- Dritte Schale (M-Schale) = 18 Elektronen = 9 Elektronenwolken
- Vierte Schale (N-Schale) = 32 Elektronen = 16 Elektronenwolken
Die Anzahl Elektronen, die in der n-ten Schale Platz haben, berechnen sich nach der Formel
- Maximale Elektronenanzahl = 2•n2.
Allerdings nimmt jede äußere Schale, wie schon im Bohrschen Modell, nicht mehr als 8 Elektronen auf.
Regeln zum Auffüllen der Elektronenwolken
- In der ersten Schale gibt es nur eine Kugelwolke, die zentral um den Kern angeordnet ist.
- Ab der zweiten Schale werden immer erst 4 Elektronenwolken angelegt, erst in den Nebengruppen werden sie auf die Endzahl erweitert (allerdings spielt das bei der chemischen Bindung keine Rolle)
- Jede der vier Elektronenwolken wird aufgrund der Abstoßung der Elektronen zuerst einfach besetzt. Erst ab dem 5. Elektron auf der Schale sind die Elektronen paarweise in den Elektronenwolken verteilt.
- Die Elektronenwolken versuchen immer einen möglichst großen Abstand zu erreichen, weshalb sie tetraedrisch angeordnet sind.
- Die Besetzung der inneren Schalen wird nicht beachtet, da sie bei der chemischen Bindung keine Rolle spielen.[1]
- Die weitere Besetzung der Elektronenwolken und Schalen erfolgt nach dem Madelung-Energieschema.
Beispiele
Die folgende Grafik stellt in der Valenzstrichschreibweise die Elemente der 2. Periode dar. Vollbesetzte Kugelwolken werden durch einen Strich und halbbesetzte durch einen Punkt dargestellt.
Weblinks
- kurze Einführung auf dem Landesbildungsserver BW
- Weiterführende Betrachtungen und Visualisierungen zum quantitativen Lewis-Modell, das auf Kimballs Kugelwolken basiert von Ernst Schumacher (englisch)
Einzelnachweise
- ↑ Elemente Chemie I – Baden-Württemberg, 2004, S. 162–165.