Patch-Clamp-Technik
Die Patch-Clamp-Technik (englisch patch clamp technique) ist eine Messmethode in der Elektrophysiologie, mit der sich der Strom durch einzelne Ionenkanäle in der Zellmembran einer Zelle darstellen lässt, gemessen werden dabei Stromstärken von wenigen Picoampere (10−12 Ampere). Diese Technik wurde erstmals 1976 von Erwin Neher und Bert Sakmann beschrieben.[1] Für ihre Arbeiten zur Funktion einzelner zellulärer Ionenkanäle, die sie mit dieser Technik durchgeführt hatten, wurden sie 1991 mit dem Nobelpreis für Physiologie oder Medizin ausgezeichnet[2]. Durch die Möglichkeit, das elektrische Verhalten von Membranproteinen an einzelnen Molekülen zu beobachten, revolutionierte die Patch-Clamp-Technik die elektrophysiologische Forschung.
Die Bezeichnung Patch bezieht sich auf den kleinen Membranausschnitt (engl. {{Modul:Vorlage:lang}} Modul:Multilingual:149: attempt to index field 'data' (a nil value): Flicken) unter der Patch-Pipette, die zugleich als Messelektrode dient. Während der Messung wird der Membranpatch auf einem vorgegebenen Potential gehalten (engl. {{Modul:Vorlage:lang}} Modul:Multilingual:149: attempt to index field 'data' (a nil value): befestigen, festklemmen). Abhängig davon, ob nach dem Aufsetzen der Patch-Pipette dieser Membranbereich aus der Zelle herausgelöst oder an der intakten Zelle gemessen wird, werden bestimmte Konfigurationen[3] in der Patch-Clamp-Technik unterschieden.
Überblick
Die Patch-Clamp-Technik baut auf der Technik der Spannungsklemme auf (englisch {{Modul:Vorlage:lang}} Modul:Multilingual:149: attempt to index field 'data' (a nil value); engl. {{Modul:Vorlage:lang}} Modul:Multilingual:149: attempt to index field 'data' (a nil value): befestigen, festklemmen; engl. {{Modul:Vorlage:lang}} Modul:Multilingual:149: attempt to index field 'data' (a nil value): Spannung), die in den 1930er Jahren von Kenneth Cole und H. J. Curtis[4] zur Messung von Strömen an intakten Nervenzellen entwickelt wurde. Bei diesem Verfahren werden zwei Elektroden in die Zelle gestochen: eine dient dazu, eine Halte- oder Kommando-Spannung vorzugeben, während mit einer weiteren Elektrode die auftretenden Ströme über die Membran aufgezeichnet werden. Mittels dieser Technik wird die Summe aller Einzelströme durch die Zellmembran gemessen, die Auflösung einzelner Anteile ist nicht möglich.
Alle Zellen enthalten in der sie umgebenden Plasmamembran sogenannte Ionenkanäle – Proteine, die für die Ionen gelöster Salze wie Poren wirken können. Ionenkanäle finden sich ebenso in den Membranen im Inneren der Zelle, bei Pflanzen beispielsweise im Tonoplast – der Membran, die die Zentralvakuole vom Cytoplasma abgrenzt. Bei lebenden Zellen sind diese Ionen auf der Außen- und Innenseite der Zellmembran in ungleicher Konzentration vorhanden; diese Ungleichverteilung führt zu einer elektrischen Spannung über die Membran, dem Transmembranpotential. Ionenkanäle spielen eine wichtige Rolle sowohl für die Aufrechterhaltung des Ruhemembranpotentials der Zelle als auch für mögliche Änderungen, die, wenn sie sprunghaft verlaufen, Aktionspotentiale genannt werden. Aktionspotentiale dienen der Weiterleitung von elektrischen Reizen im Organismus (beispielsweise bei der Erregungsleitung). Das Ruhemembranpotential nimmt typischerweise Werte von etwa −70 mV für tierische und bis zu −200 mV bei pflanzlichen Zellen an.
Da die Trägersubstanz von Biomembranen, die Lipiddoppelschicht, für Wasser und gelöste Ionen praktisch undurchlässig ist, wurde früh vermutet, dass eine Leitfähigkeitsänderung nur durch Öffnen oder Schließen spezifischer Membranproteine, der Ionenkanäle, erreicht werden kann. Die beiden britischen Wissenschaftler Alan Hodgkin und Andrew Huxley entwickelten ein Modell, das das Vorhandensein spannungsabhängiger Tore (engl. {{Modul:Vorlage:lang}} Modul:Multilingual:149: attempt to index field 'data' (a nil value)), die sich nach dem Alles-oder-Nichts-Prinzip vollständig öffnen oder schließen, in der Zellmembran vorhersagte. 1969 konnte für das bakterielle Membranprotein Gramicidin A diese Tor-Funktion erstmals nachgewiesen werden.[5][6]
Mit Voltage-Clamp-Messungen war es jedoch nicht möglich, die molekularen Mechanismen dieser Tore, der Ionenkanäle, zu erforschen. Das Verfahren wurde in der Patch-Clamp-Technik wesentlich weiterentwickelt. Hier wird die Elektrode nicht mehr in die Zelle eingestochen, sondern unmittelbar auf die Zellmembran aufgesetzt. Durch die sehr kleine Austrittsöffnung der Pipette (ungefähr 1 µm) gelingt mit großer Wahrscheinlichkeit, ein einzelnes Ionenkanalprotein zu erfassen. Gleichzeitig wird eine elektrisch dichte Verbindung zwischen dem Glasrand der Messelektrode und der Zellmembran hergestellt, so dass auftretende Leckströme vernachlässigt werden können. So können sehr kleine Ströme (in der Größenordnung von 5 pA) gemessen werden. Die Elektrode dient dabei zugleich zur Vorgabe von Halte- oder Kommandospannungen als auch zur Messung der Ionenströme. Diese doppelte Aufgabe wird möglich durch den Einsatz eines mit virtueller Masse geschalteten Operationsverstärkers in der Messelektronik; eine zweite Elektrode mit Zellkontakt kann entfallen.
Insgesamt stellt die Patch-Clamp-Technik hohe Anforderungen an die verwendeten Geräte und die Messelektronik (Rauscharmut, Langzeitstabilität), zugleich erfordert sie vom Experimentator ausgeprägtes Geschick im Umgang mit Gerät und biologischem Material.
Geräte und Materialien
Messplatz
Für Arbeiten mit der Patch-Clamp-Technik wird meist ein Messplatz eingerichtet, der typischerweise mit verschiedenen Geräten ausgestattet ist. Auf einem schwingungsgedämpften Messtisch steht ein Faraday-Käfig zur elektrischen Abschirmung. Darin befindet sich ein inverses Mikroskop mit einem Mikromanipulator zur Positionierung der Patch-Pipette. Der Pipettenhalter ist mit dem Vorverstärker verbunden, der Probenhalter mit der Badelektrode. Das Signal des Vorverstärkers wird im Patch-Clamp-Verstärker verstärkt. Ein Monitor dient zur Beobachtung des Messobjektes und der Patch-Pipette durch die Mikroskop-Kamera. Meist befindet sich zur Auswertung und Aufzeichnung der elektrischen Signale noch ein Computer sowie Datenspeicher unmittelbar am Messplatz für die digitale Aufzeichnung. Das Verhalten der Zelle kann auch mit einem Videorekorder aufgezeichnet werden.
Messelektrode (Patch-Pipette)
Die Messelektrode wird aus einer Glaskapillare angefertigt, die dazu unter Hitzeeinwirkung sehr dünn ausgezogen wird. Als Glasmaterial dient meist Borosilikatglas; das Ausziehen kann mit geeigneten Geräten (engl. {{Modul:Vorlage:lang}} Modul:Multilingual:149: attempt to index field 'data' (a nil value)) automatisiert werden; dabei lassen sich Parameter wie Heiztemperatur und Zugspannung einstellen. Oftmals wird die Spitze der Pipette nach dem Ziehen noch hitzepoliert, wodurch möglichst glatte Ränder an der Spitze erzeugt werden, die die Ausbildung einer elektrisch dichten Verbindung (Gigaseal) zwischen Pipette und Membran begünstigen.
Zur Elektrode wird die Pipette durch Füllen mit einer leitfähigen Lösung, in die ein mit Silberchlorid beschichteter Silberdraht taucht. Die gefüllte Patch-Pipette wird in den Halter gespannt und an den dort angebrachten Vorverstärker angeschlossen, zusammen mit einer weiteren Silberdrahtelektrode, die in der Badlösung liegt. Die kurze Entfernung zwischen Messelektrode und Verstärker ist notwendig, um die Überlagerung der sehr kleinen Messströme durch äußere Störsignale auf ein Minimum zu reduzieren. Der Widerstand der mit Lösung befüllten Messelektrode beträgt typischerweise zwischen 1 und 5 MΩ. Eine zusätzliche Beschichtung der Patch-Pipette mit Silikonelastomeren verringert das Rauschen der Messanordnung und verhindert, dass sich ihre elektrische Kapazität durch Benetzung mit der Badlösung erhöht. Dabei bleibt die Spitze bis auf etwa 50 µm frei.
Ein Gigaseal bildet sich meist nur, wenn frisch (wenige Stunden alt) hergestellte Patch-Pipetten für die Messung verwendet werden.
Vorbereiten der Zellen
Die äußere Zellmembran von Zellen ist selten uneingeschränkt zugänglich; für eine Patch-Clamp-Messung müssen die Zellen daher oft erst vorbereitet werden.
Tierzellen
Tierische Zellen können enzymatisch von der Basallamina abgelöst und von Resten des Bindegewebes befreit werden. Dieser Schritt kann bei Zellen, die in Zellkultur gewachsen sind, manchmal entfallen.
Pflanzenzellen
Pflanzliche Zellen sind von einer Zellwand umgeben, diese wird meist durch enzymatische Verdauung mit Cellulasen und Hemicellulasen entfernt. Sobald die Bestandteile der Zellwand ausreichend abgebaut wurde, können die Zellen durch einfaches, leichtes Schütteln oder durch Überführen in eine hypoosmotische Lösung[7] aus den noch vorhandenen Resten herausgelöst werden. Solche Protoplasten (Zellen ohne Zellwand) beginnen oft unmittelbar nach der Entfernung aus dem Enzymbad wieder mit der Neubildung von Zellwandmaterial, die Messung sollte daher möglichst schnell nach dem Protoplastieren erfolgen.
Durchführung der Messung
Die gefüllte Patch-Pipette wird in einem Mikromanipulator gespannt, an den Patch-Clamp-Verstärker angeschlossen und dann unter optischer Kontrolle (Beobachtung im Mikroskop oder auf einem daran angeschlossenen Monitor) vorsichtig auf eine intakte Zelle gedrückt. Unterhalb der Pipette, innerhalb des Durchmessers der Spitze, befindet sich ein Stück Membran – der Patch oder Membranfleck (engl. {{Modul:Vorlage:lang}} Modul:Multilingual:149: attempt to index field 'data' (a nil value) – Fleck). Anschließend wird durch leichten Unterdruck, der am hinteren Ende der Pipette angelegt wird, eine starke Verbindung (Versiegelung) zwischen Membran und Pipette erzeugt. Zwischen dem Inneren der Pipette und der Außenlösung entsteht dadurch ein elektrischer Widerstand in der Größenordnung von mehreren Gigaohm (109 Ohm), der sogenannte „Gigaseal“ (engl. {{Modul:Vorlage:lang}} Modul:Multilingual:149: attempt to index field 'data' (a nil value) – versiegeln). Mit der Herstellung des Gigaseals ist die sogenannte Cell-Attached-Konfiguration der Patch-Clamp-Technik erreicht (engl. {{Modul:Vorlage:lang}} Modul:Multilingual:149: attempt to index field 'data' (a nil value) – anheften, befestigen an, festmachen an). Durch den hohen Widerstand des Gigaseals muss ein Strom, der durch einen Ionenkanal innerhalb des Patches fließt, auch durch den Pipetteninhalt fließen. In die Pipettenlösung taucht eine Elektrode, die an einen empfindlichen Verstärker angeschlossen ist. Dadurch ist es möglich, die Aktivität eines einzelnen Ionenkanals in der Membran des Patches zu messen. Sowohl die Zellmembran, deren Bestandteil der Patch ist, als auch das Innere der Zelle bleiben in dieser Konfiguration intakt.
Durch weiteres Anlegen von Unterdruck am Ende der Pipette oder kurze Pulse elektrischer Spannung an der Elektrode in der Pipette kann der Patch geöffnet werden, während der Gigaseal intakt bleibt. Zwischen dem Inneren der Pipette und dem Inneren der Zelle besteht nun eine Kontinuität, während beide gegen die Außenlösung durch den hohen Widerstand des Gigaseals isoliert sind. Diese Konfiguration der Patch-Clamp-Technik wird als Whole-Cell-Konfiguration bezeichnet (engl. {{Modul:Vorlage:lang}} Modul:Multilingual:149: attempt to index field 'data' (a nil value) – ganze Zelle). In dieser Konfiguration wird von der gesamten Zellmembran abgeleitet. Da die Pipettenlösung das Innere der Zelle füllt, muss sie in ihrer Zusammensetzung dem Cytosol ähnlich sein. Gleichzeitig bietet diese Konfiguration die Möglichkeit, über die Pipettenlösung die Zelle von innen her zu manipulieren.
Wenn nach Erreichen der Cell-Attached-Konfiguration der Patch nicht geöffnet wird, sondern die Pipette sanft von der Zelle abgezogen wird, löst sich der unter der Pipettenspitze befindliche Teil der Membran von der Zelle und verbleibt an der Pipette. Dabei weist die vormals innere Seite dieses Membranstücks nun nach außen in die Badlösung, während die vormals äußere Seite des Membranstücks sich im Inneren der Pipette befindet. Das ist die sogenannte Inside-Out-Konfiguration. Ähnlich wie die Cell-Attached-Konfiguration ermöglicht sie die Messung einzelner Ionenkanäle im Membranstück an der Pipettenspitze. Im Unterschied zu dieser jedoch kann in der Inside-Out-Konfiguration das Milieu an der Innenseite der Membran manipuliert werden. Füllt man die Pipette mit einer Lösung, die das extrazelluläre Milieu simuliert, kann man das Verhalten der Ionenkanäle in Abhängigkeit von der Zusammensetzung des Cytosols untersuchen. Zusätzlich gibt es die Möglichkeit der Untersuchung von Einzelionenkanälen mit Hilfe der Outside-Out-Konfiguration. Dabei wölbt sich das patch aus der Pipettenöffnung heraus und die äußere Membranseite befindet sich nun in der Badlösung. In diesem Fall kann das Milieu des extrazellulären Raumes moduliert werden, während das cytosolische Milieu erhalten bleibt.
Es ist mit diesem Verfahren sogar möglich, die Funktion von Zellen in ihrer natürlichen Umgebung im lebenden Organismus (in vivo) zu messen.
Planares Patch-Clamp
Planares Patch-Clamp ist eine neue Methode, die entwickelt wurde, um den Durchsatz in der Elektrophysiologie zu erhöhen, unter Anderem um dem wachsenden Bedarf an Patch-Clamp-Messungen in der Pharmaforschung erfüllen zu können.[8][9][10][11]
Anstatt eine Pipette auf eine adhärente Zelle zu positionieren, wird Zell-Suspension auf einen Chip pipettiert, in den eine mikrostrukturierte Öffnung (Apertur) eingebracht wurde.
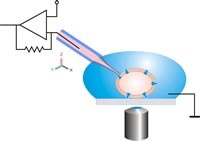
Eine einzelne Zelle wird dann mit Unterdruck auf das Loch gesaugt und eine elektrisch dichte Verbindung zwischen Zelle und Glas ausgebildet (Gigaseal). Die Planare Geometrie bietet verglichen mit dem herkömmlichen Patch-Clamp-Verfahren einige Vorteile, wie z. B. die Integration von mikrofluidischen Kanälen erlaubt automatisierte Wirkstoffzugabe, wie sie in der Pharmaforschung benötigt wird. Das System ist für optische und rastersondenmikroskopische Verfahren zugänglich. Die Perfusion der Intrazellulärseite ist sehr viel einfacher möglich, wodurch Wirkstoffe besser untersucht werden können, die intrazellulär wirken. Für die Durchführung der Messungen ist keine spezielle Ausbildung nötig. Nicht-adhärente Zellen (wie rote Blutkörperchen), die sich klassisch nur sehr schwer untersuchen lassen, sind planar sehr viel einfacher zu patchen. Die Messaufbauten können miniaturisiert werden. Während ein klassischer Aufbau leicht einen halben Laborraum ausfüllen kann, lässt sich ein planarer Aufbau auch als Tischgerät realisieren.
Den Vorteilen stehen einige Nachteile gegenüber, wie z. B. die Haftung von Zellen wie Neuronen oder Makrophagen an der Oberfläche, auf der sie kultiviert wurden. Bei der enzymatischen Ablösung muss sichergestellt werden, dass die Proteasen die Kanalproteine auf der Zelloberfläche nicht beeinträchtigen. Adhärente Zellen können also nicht unter streng physiologischen Bedingungen gepatcht werden. Die weiteste Verbreitung haben Planar-Patch-Systeme daher bei transfizierten Zellkulturen. Da die Zellen vereinzelt werden müssen, sind keine Messungen an Gewebeschnitten möglich. Es muss sichergestellt werden, dass die Zellsuspension homogen ist, da die gepatchte Zelle aus dem Ensemble „blind“ ausgesucht wird. Die Zelle kann also nicht anhand ihrer Form oder eines fluoreszierenden Labels ausgesucht werden. Trotz der weitgehenden Miniaturisierung liegen die Anschaffungskosten pro Messkanal in einem ähnlichen Bereich wie beim konventionellen Patch-Clamp. Hochparallele Systeme lohnen sich daher erst bei entsprechend hohen Durchgangszahlen.
Siehe auch
- Neurophysiologie
Literatur
- E. Neher, B. Sakmann: Die Erforschung von Zellsignalen mit der Patch-Clamp-Technik. Spektrum der Wissenschaft, Mai 1992, S. 48–56.
- Erwin Neher: Ion Channels For Communication Between and Within Cells. Nobelpreisvortrag Dez. 1991. (engl., PDF)
- B. Sakmann, E. Neher: Single-Channel Recording. Springer, 1995, ISBN 1-4615-7858-2.
- M. Numberger, A. Draguhn: Patch-Clamp Technik. Spektrum Akademischer Verlag, Heidelberg 1996, ISBN 3-8274-0023-6.
- B. Hille: Ion channels in excitable membranes., 3. Ausgabe, Sunderland 2001, ISBN 0-87893-321-2.
Weblinks
- D. C. Ogden: Microelectrode techniques, The Plymouth workshop handbook. 2nd Edit. Company of Biologists, Cambridge 1994, ISBN 0-948601-49-3. (engl., PDF).
- Flash-Animation zu den Grundlagen der Patch-Clamp-Technik
Einzelnachweise
- ↑ E. Neher, B. Sakmann. Single-channel currents recorded from membrane of denervated frog muscle fibers. In: Nature. 260, 1976, S. 799–801.
- ↑ Informationen der Nobelstiftung zur Preisverleihung 1991 an Erwin Neher und Bert Sakmann (englisch)
- ↑ O. P. Hamill, E. Neher, B. Sakmann, F. J. Sigworth: Improved patch-clamp techniques for high-resolution current recordings from cells and cell-free membrane patches. In: Pflügers Arch. 391, 1981, S. 85–100.
- ↑ K. S. Cole: Mostly Membranes. In: Annu Rev Physiol. 41, 1979, S. 1–24.
- ↑ R.C. Bean, W.C. Shepherd, H. Chan, J. T. Eichler: Discrete conductance fluctuations in lipid bilayer protein membranes. In: J. Gen. Physiol. 53, 1969, S. 741–757, doi:10.1085/jgp.53.6.741.
- ↑ S. B. Hladky, D. A. Haydon: Discreteness of conductance change in bimolecular lipid membranes in the presence of certain antibiotics. In: Nature. 225, 1970, S. 451–453, doi:10.1038/225451a0.
- ↑ Sake Vogelzang: The state of plasma membrane polarization in plant cells. Proefschrift, Rijksuniversiteit Groningen, 1996.
- ↑ Christian Schmidt, Michael Mayer, Horst Vogel: A Chip-Based Biosensor for the Functional Analysis of Single Ion Channels13. In: Angewandte Chemie. Band 112, Nr. 17, 2000, S. 3267–3270, doi:10.1002/1521-3757(20000901)112:17<3267::AID-ANGE3267>3.0.CO;2-1.
- ↑ Jan C. Behrends, Niels Fertig: Planar Patch Clamping. In: Neuromethods. Bd. 38, S. 411–433 (PDF).
- ↑ Kleine Löcher, große Wirkung - Zellphysiologie im Chipformat. Deutschen Zukunftspreis Nominiertenliste 2007, abgerufen am 18. April 2010.
- ↑ Ionenkanalmessungen im Hochdurchsatz – vom Uni-Labor zum Global Player. Deutschen Zukunftspreis Nominiertenliste 2014, abgerufen am 6. März 2015.