Suszeptibilitätsgewichtete Bildgebung
- Wikipedia:Vorlagenfehler/Vorlage:Cite journal/Parameter language fehlt
- Radiologie
- Tomografie
- Diagnostisches Verfahren in der Angiologie
- Kernspinresonanz
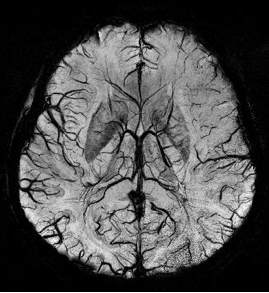
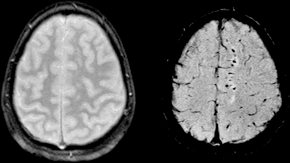
Die Suszeptibilitätsgewichtete Bildgebung (SWI) (englisch susceptibility-weighted imaging, von lateinisch susceptibilitas „Übernahmefähigkeit“) ist ein bildgebendes Verfahren der medizinischen Diagnostik speziell im Bereich der venösen Gefäße. Es basiert auf der physikalischen Eigenschaft der magnetischen Suszeptibilität.
SWI ist ein Magnetresonanztomographie-Verfahren. Sie benutzt flusskompensierte, räumlich hochaufgelöste 3D-Gradientenechosequenzen (GRE-Sequenz) in Einzel- und Multiechotechnik[1] unter Ausnutzung der unterschiedlichen magnetischen Suszeptibilitäten der verschiedenen Gewebe. Diese Unterschiede führen zu einer Phasendifferenz (phase) und bewirken einen Signalverlust (magnitude). Es kommt kein Kontrastmittel zum Einsatz. Mit der Kombination der Signal- und Phasenbilder wird ein erweitertes Kontrastsignalbild erzeugt, welches venöses Blut, (Hirn-)Blutungen und Eisenablagerungen wie Hämosiderin darstellen kann.
Die Bildgebung von venösem Blut mit SWI wird als Blut-Sauerstoff-abhängige Bildgebung (BOLD, blood-oxygen-level dependent) bezeichnet. Venöses (sauerstoffarmes) Blut ist weniger diamagnetisch als arterielles (sauerstoffreiches) Blut. Das Verfahren wurde deshalb ursprünglich als BOLD bezeichnet jedoch später durch den allgemeineren Begriff suszeptibilitätsgewichtete Bildgebung ersetzt. Der Begriff BOLD-Venographie ist heutzutage manchmal noch in Gebrauch. Aufgrund des BOLD-Effektes lässt sich mit SWI das venöse Gefäßsystem gut darstellen.
SWI kann bei Schädel-Hirn-Trauma, bei hochauflösenden Gehirnvenographien und anderen klinischen Anwendungen zum Einsatz kommen. Das zugrundeliegende Prinzip wurde 1997 erstmals publiziert[2] und 2001 umfassend beschrieben.[3]
Klinische Anwendung
Die klinische Anwendung wird in verschiedenen Gebieten der Medizin erforscht:[4][5][6] Schädel-Hirn-Trauma,[7] Hirnschlag,[8] Cerebrale Amyloidangiopathie (CAA),[9] Gefäßmalformation (Sturge-Weber-Syndrom,[10] Cerebrale venöse Sinusthrombosen[11]), Multiple Sklerose,[12][13] Alzheimer-Krankheit[14] und Hirntumor.[15][16]
Geräte
SWI ist in neueren Geräten verschiedener Hersteller integriert und kann im Prinzip geräteunabhängig bei Feldstärken von 1.0 T, 1.5 T, 3.0 T und höher durch entsprechende Software[17] angewandt werden.
Historische Entwicklung
1997 wurde das grundlegende Verfahren der Entfernung von störenden Phasendifferenz-Artefakte unter dem Erhalt der lokalen interessanten Phasendifferenz entwickelt.[2] 2001 wurde das SWI zugrundeliegende Prinzip von E. Mark Haacke und Jürgen R. Reichenbach umfassend beschrieben.[3]
Siehe auch
- Magnetresonanzangiographie
- Funktionelle Magnetresonanztomographie
- CT-Angiographie
- Phlebografie
- Sonografie
Weblinks
- Suszeptibilitätsgewichtete Bildgebung (SWI). Universität Jena
- SWI Informationen inkl. SWI Software, MRI Institute for Biomedical Research
Einzelnachweise
- ↑ Denk C, Rauscher A: Susceptibility weighted imaging with multiple echoes. In: J Magn Reson Imaging. 31. Jahrgang, Nr. 1, Januar 2010, S. 185–91, doi:10.1002/jmri.21995, PMID 20027586.
- ↑ 2,0 2,1 JR Reichenbach, R Venkatesan, DJ Schillinger, DK Kido, EM Haacke: Small vessels in the human brain: MR venography with deoxyhemoglobin as an intrinsic contrast agent. In: Radiology. 204. Jahrgang, Nr. 1, Juli 1997, S. 272–7, PMID 9205259.
- ↑ 3,0 3,1 JR Reichenbach, EM Haacke: High-resolution BOLD venographic imaging: a window into brain function. In: NMR Biomed. 14. Jahrgang, Nr. 7–8, 2001, S. 453–67, doi:10.1002/nbm.722, PMID 11746938.
- ↑ EM Haacke, S Mittal, Z Wu, J Neelavalli, YC Cheng: Susceptibility-weighted imaging: technical aspects and clinical applications, part 1. In: AJNR Am J Neuroradiol. 30. Jahrgang, Nr. 1, Januar 2009, S. 19–30, doi:10.3174/ajnr.A1400, PMID 19039041.
- ↑ S Mittal, Z Wu, J Neelavalli, EM Haacke: Susceptibility-weighted imaging: technical aspects and clinical applications, part 2. In: AJNR Am J Neuroradiol. 30. Jahrgang, Nr. 2, Februar 2009, S. 232–52, doi:10.3174/ajnr.A1461, PMID 19131406.
- ↑ E. Mark Haacke: Susceptibility Weighted Imaging (SWI) (PDF; 5,1 MB) 2006. Abgerufen am 3. April 2010.
- ↑ KA Tong, S Ashwal, BA Holshouser, LA Shutter, G Herigault, EM Haacke, DK Kido: Hemorrhagic shearing lesions in children and adolescents with posttraumatic diffuse axonal injury: improved detection and initial results. In: Radiology. 227. Jahrgang, Nr. 2, Mai 2003, S. 332–9, doi:10.1148/radiol.2272020176, PMID 12732694.
- ↑ M Hermier, N Nighoghossian: Contribution of susceptibility-weighted imaging to acute stroke assessment. In: Stroke: A Journal of Cerebral Circulation. 35. Jahrgang, Nr. 8, August 2004, S. 1989–94, doi:10.1161/01.STR.0000133341.74387.96, PMID 15192245.
- ↑ EM Haacke, ZS DelProposto, S Chaturvedi, V Sehgal, M Tenzer, J Neelavalli, D Kido: Imaging cerebral amyloid angiopathy with susceptibility-weighted imaging. In: AJNR Am J Neuroradiol. 28. Jahrgang, Nr. 2, Februar 2007, S. 316–7, PMID 17297004.
- ↑ Juhász C, EM Haacke, J Hu, Y Xuan, M Makki, ME Behen, M Maqbool, O Muzik, DC Chugani, HT Chugani: Multimodality imaging of cortical and white matter abnormalities in Sturge-Weber syndrome. In: AJNR Am J Neuroradiol. 28. Jahrgang, Nr. 5, Mai 2007, S. 900–6, PMID 17494666.
- ↑ M Kawabori, S Kuroda, K Kudo, S Terae, M Kaneda, N Nakayama, Y Iwasaki: Susceptibility-weighted magnetic resonance imaging detects impaired cerebral hemodynamics in the superior sagittal sinus thrombosis--case report. In: Neurol. Med. Chir. (Tokyo). 49. Jahrgang, Nr. 6, Juni 2009, S. 248–51, PMID 19556733 (jst.go.jp).
- ↑ EM Haacke, J Garbern, Y Miao, C Habib, M Liu: Iron stores and cerebral veins in MS studied by susceptibility weighted imaging. In: Int Angiol. 29. Jahrgang, Nr. 2, April 2010, S. 149–57, PMID 20351671.
- ↑ EM Haacke, M Makki, Y Ge, M Maheshwari, V Sehgal, J Hu, M Selvan, Z Wu, Z Latif, Y Xuan, O Khan, J Garbern, RI Grossman: Characterizing iron deposition in multiple sclerosis lesions using susceptibility weighted imaging. In: J Magn Reson Imaging. 29. Jahrgang, Nr. 3, März 2009, S. 537–44, doi:10.1002/jmri.21676, PMID 19243035, PMC 2650739 (freier Volltext).
- ↑ R Chamberlain, D Reyes, GL Curran, M Marjanska, TM Wengenack, JF Poduslo, M Garwood, CR Jack: Comparison of amyloid plaque contrast generated by T2-weighted, T2*-weighted, and susceptibility-weighted imaging methods in transgenic mouse models of Alzheimer’s disease. In: Magn Reson Med. 61. Jahrgang, Nr. 5, Mai 2009, S. 1158–64, doi:10.1002/mrm.21951, PMID 19253386.
- ↑ V Sehgal, Z Delproposto, D Haddar, EM Haacke, AE Sloan, LJ Zamorano, G Barger, J Hu, Y Xu, KP Prabhakaran, IR Elangovan, J Neelavalli, JR Reichenbach: Susceptibility-weighted imaging to visualize blood products and improve tumor contrast in the study of brain masses. In: J Magn Reson Imaging. 24. Jahrgang, Nr. 1, Juli 2006, S. 41–51, doi:10.1002/jmri.20598, PMID 16755540.
- ↑ M Barth, Nöbauer-Huhmann IM, JR Reichenbach, Mlynárik V, A Schöggl, C Matula, S Trattnig: High-resolution three-dimensional contrast-enhanced blood oxygenation level-dependent magnetic resonance venography of brain tumors at 3 Tesla: first clinical experience and comparison with 1.5 Tesla. In: Invest Radiol. 38. Jahrgang, Nr. 7, Juli 2003, S. 409–14, doi:10.1097/01.RLI.0000069790.89435.e7, PMID 12821854 (wkhealth.com).
- ↑ SPIN Software. Abgerufen am 3. April 2010. A software for MRI DICOM data post-processing, incl SWI processing.
| Dieser Artikel behandelt ein Gesundheitsthema. Er dient nicht der Selbstdiagnose und ersetzt keine Arztdiagnose. Bitte hierzu diesen Hinweis zu Gesundheitsthemen beachten! |