Faraday-Konstante
| Physikalische Konstante | |
|---|---|
| Name | Faraday-Konstante |
| Formelzeichen | |
| Wert | |
| SI | 9.64853321233100184e4 |
| Unsicherheit (rel.) | (exakt) |
| Bezug zu anderen Konstanten | |
Die Faraday-Konstante
Wert und Einheit
Sie wird aus der Avogadro-Konstanten
und hat den Wert:
Die SI-Einheiten Mol und Coulomb sind dadurch definiert, dass den Konstanten
Bedeutung
Die Faraday-Konstante wird häufig in Berechnungen in der Physik und Chemie, insbesondere der Elektrochemie, verwendet. Sie ist eine unveränderliche Größe, also eine Naturkonstante. Sie wird dann verwendet, wenn Stoffumsätze mit elektrischen Ladungen verknüpft sind, etwa bei Elektrolysen, zum Beispiel bei der Galvanik, oder bei Brennstoffzellen und Batterien. Somit ist sie nicht nur in der Wissenschaft, sondern auch in der Technik von Bedeutung, besonders in der Galvanotechnik.
Sie wird auch zur Berechnung der Änderung der Energie verwendet, die ein Mol Elektronen bei Durchlaufen einer Potentialdifferenz aufnehmen oder abgeben (also der molaren Energiedifferenz), und findet praktische Anwendung bei der Berechnung von allgemeinen Reaktionsparametern, wie der Umrechnung elektrischer Potentiale in freie Energie. Eine Energie von 1 kJ/mol entspricht heruntergebrochen auf ein Teilchen 1000 J/(NA/mol−1), und ausgedrückt in Elektronenvolt (eV) mit 1 eV=1 J·e/C ergibt sich:
Bestimmung
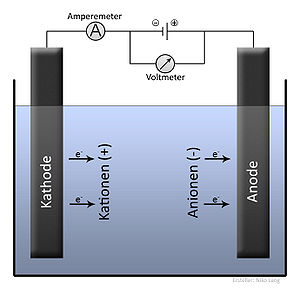
Bis zur Revision des Internationalen Einheitensystems am 20. Mai 2019 war die Faraday-Konstante eine Größe, die experimentell bestimmt werden musste. Ihre Bestimmung erfolgte meist coulometrisch durch Elektrolyse, bei der sich F anhand der Faradayschen Gesetze aus der Masse, der molaren Masse, dem Strom und der Zeit (Elektrolysendauer) berechnen ließ.
Ein klassisches Beispiel ist die Elektrolyse von Silber in einer Lösung von Silbernitrat (→ siehe Silbercoulometer). Die einfach geladenen Silberionen nehmen durch den fließenden Strom Ladungen auf, und festes Silber scheidet sich ab:
Die Atommasse (Atomgewicht) von Silber beträgt 107,86 u, und somit hat ein Mol Silber die Masse 107,86 g.[A 1] Da das Silberion die Ladung 1 e trägt, sind zur Abscheidung dieser Menge Silber so viele Elementarladungen erforderlich, wie Teilchen in einem Mol sind, also der Zahlenwert von NA. Die Ladungsmenge Q wiederum ist das Produkt aus Strom und Zeit: Q = I·t. Allgemein gilt:
und
mit
wobei mAtom in u und M in g/mol denselben Zahlenwert haben.[A 1]
Die Faradaysche Konstante lässt sich also durch makroskopisch zugängliche Größen bestimmen: die elektrolytisch abgeschiedene Masse und die molare Masse (Atomgewicht).
Historisches
Den linearen Zusammenhang zwischen Stoffumsatz und transportierter elektrischer Ladungsmenge erkannte Michael Faraday, der 1834 entsprechend die Faradayschen Gesetze formulierte.
Als man später im 19. Jahrhundert die Existenz von Atomen und Molekülen sowie die Existenz einer Elementarladung erkannte oder vermutete, erhielt man über Faradaysche Konstante eine Beziehung zwischen zwei mikroskopischen Größen, der Masse eines Atoms und der Elementarladung, ohne dass man diese selbst direkt messen musste. Nachdem Josef Loschmidt 1865 erstmals die Größe von Luftmolekülen bestimmt hatte, woraus die Avogadro-Konstante abgeleitet werden konnte, gab George Johnstone Stoney 1874 eine erste Abschätzung für die Elementarladung.
Anmerkungen
Einzelnachweise
- ↑ 1,0 1,1 CODATA Recommended Values. National Institute of Standards and Technology, abgerufen am 3. August 2019. Wert für die Faraday-Konstante. Der Wert ist als Produkt zweier exakter Werte ebenfalls exakt, wird aber bei CODATA nur mit den ersten zehn geltenden Ziffern, gefolgt von Punkten angegeben. Die in der Infobox angegebenen Ziffern sind alle geltenden.