Faraday-Konstante
| Physikalische Konstante | |
|---|---|
| Name | Faraday-Konstante |
| Formelzeichen | |
| Wert | |
| SI | |
| Unsicherheit (rel.) | |
| Bezug zu anderen Konstanten | |
| Quellen und Anmerkungen | |
| Quelle SI-Wert: CODATA 2014 (Direktlink) | |
Die Faraday-Konstante
Sie nimmt in den Faradayschen Gesetzen eine wichtige Rolle ein, ihr Wert beträgt nach derzeitiger Messgenauigkeit:[1]
(also mit einer geschätzten Standardabweichung von 0,000 59 C · mol−1 )
Bedeutung
Die Faraday-Konstante wird häufig in Berechnungen in der Physik und Chemie, insbesondere der Elektrochemie, verwendet. Sie ist eine unveränderliche Größe, also eine Naturkonstante. Sie wird dann verwendet, wenn Stoffumsätze mit elektrischen Ladungen verknüpft sind, etwa bei Elektrolysen, zum Beispiel bei der Galvanik, oder bei Brennstoffzellen und Batterien. Somit ist sie nicht nur in der Wissenschaft, sondern auch in der Technik von Bedeutung, besonders in der Galvanotechnik.
Sie wird auch zur Berechnung der molaren Änderung der Energie verwendet, die ein Mol Elektronen bei Durchlaufen einer Potentialdifferenz aufnehmen oder abgeben, und findet praktische Anwendung bei der Berechnung von allgemeinen Reaktionsparametern, wie der Umrechnung elektrischer Potentiale in freie Energie. Ein kJ/Mol = 1000 (eJ)/(NA e = F) ungefähr 0,01 eV.
Historisches
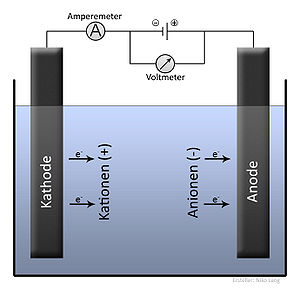
Die Faraday-Konstante ist nach Michael Faraday benannt, dessen grundlegende Arbeiten ihre erste Bestimmung ermöglicht haben. Ihre Bestimmung erfolgte erstmals bei einer galvanischen Abscheidung aus der elektrischen Ladung des geflossenen Stromes und der abgeschiedenen Menge an Silber. 1 mol Silber (Molare Masse: MAg = 107,8682 g/mol) werden durch etwa 96500 Coulomb (C) abgeschieden.
Einfache Herleitung
Es sei die Elektrolyse von Silber – stellvertretend für alle Stoffe mit einfach positiv geladenem Ion – betrachtet:
Diese Formel gilt natürlich auch, wenn statt nur eines Silberatoms und nur eines Elektrons, je ein Mol dieser Teilchen verwendet werden (ein Mol Teilchen entspricht etwa 6,022 · 1023 Teilchen):
Die Ladungsmenge Q um ein Mol Silber abscheiden zu können, bestimmt sich aus der Elementarladung e eines einzigen Ions und der Anzahl der Teilchen in einem Mol. Die Anzahl der Teilchen in einem Mol wird durch die Avogadro-Konstante NA ausgedrückt.
Die Faraday-Konstante F = Q/n als Ladungsmenge Q pro Mol (also um zum Beispiel ein Mol Silber abzuscheiden) ergibt sich somit nach:
Bei Stoffen, deren chemische Wertigkeit z vom Wert 1 verschieden ist, ist die molare Ladung ein entsprechendes Vielfaches der Faraday-Konstanten.
Bestimmung
Ihre Bestimmung erfolgt meist coulometrisch durch Elektrolyse, bei der sich F anhand der Faradayschen Gesetze aus der Masse, der molaren Masse, der Ladung Q und der Zeit (Elektrolysendauer) berechnen lässt.
Moderne coulometrische Messeinrichtungen sind auf die exakt festgelegten Werte der konventionellen 1990er Josephson-Konstante KJ-90 und der konventionellen 1990er von-Klitzing-Konstante RK-90
- KJ-90 = 4,835 979 × 1014 Hz · V−1
- RK-90 = 25 812,807 Ω
kalibriert. Bei solchen Messungen ist nicht die Faraday-Konstante F, sondern die auf die konventionellen 1990er Josephson- und von-Klitzing-Konstanten basierende Faraday-Konstante F90 in Berechnungen zu verwenden. Diese errechnet sich aus der Avogadro-Konstante NA und dem exakten Wert der konventionellen 1990er Elementarladung e90 gemäß
- F90 = NA · e90
und hat – nach der CODATA 2014-Empfehlung für NA – den Wert:[2]
- F90 = 96 485,335 1 (12) C · mol−1
Quellen
- ↑ CODATA Recommended Values. National Institute of Standards and Technology, abgerufen am 4. November 2016. Wert für die Faraday-Konstante
- ↑ CODATA Recommended Values. National Institute of Standards and Technology, abgerufen am 4. November 2016. Wert für die Faraday-Konstante F90