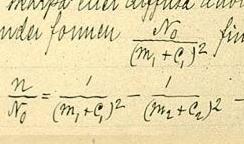Rydberg-Formel: Unterschied zwischen den Versionen
imported>Crazy1880 (Umbruch aktualisiert) |
imported>Ra-raisch (me/mp=0,0005446) |
||
| Zeile 1: | Zeile 1: | ||
[[Datei:Rydbergformula.jpg|mini|Die Rydberg-Formel in einem [[Manuskript]] von Johannes Rydberg]] | [[Datei:Rydbergformula.jpg|mini|Die Rydberg-Formel in einem [[Manuskript]] von Johannes Rydberg]] | ||
Die '''Rydberg-Formel''' (auch '''Rydberg-Ritz-Formel''') wird in der [[Atomphysik]] benutzt, um das | Die '''Rydberg-Formel''' (auch '''Rydberg-Ritz-Formel''') wird in der [[Atomphysik]] benutzt, um das [[Elektromagnetisches Spektrum|Linienspektrum]] des vom [[Wasserstoff]] [[Spontane Emission|emittierten]] Lichtes zu bestimmen. Sie zeigt, dass die [[Bindungsenergie]] des [[Elektron]]s im Wasserstoffatom [[Reziproke Proportionalität|umgekehrt proportional]] zum [[Quadrat (Arithmetik)|Quadrat]] der [[Hauptquantenzahl]] ist. | ||
Die Formel wurde am 5. November 1888 vom [[Schweden|schwedischen]] [[Physiker]] [[Johannes Rydberg]] vorgestellt; auch [[Walter Ritz]] arbeitete an ihr. Später wurde sie erweitert, um das Spektrum anderer [[Chemisches Element|Elemente]] zu bestimmen. | Die Formel wurde am 5. November 1888 vom [[Schweden|schwedischen]] [[Physiker]] [[Johannes Rydberg]] vorgestellt; auch [[Walter Ritz]] arbeitete an ihr. | ||
Korrekturen aufgrund von [[Drehimpuls]]en oder [[relativistisch]]en Effekten werden in der Rydberg-Formel ''nicht'' berücksichtigt. Später wurde sie erweitert, um das Spektrum anderer [[Chemisches Element|Elemente]] zu bestimmen (s. u. Erweiterungen). | |||
== Rydberg-Formel für Wasserstoff == | == Rydberg-Formel für Wasserstoff == | ||
: <math>\frac | === Formulierung === | ||
: <math>\frac 1 {\lambda_{\mathrm{vac}}} = R \left( \frac 1 {n_1^2}-\frac 1 {n_2^2} \right)</math> | |||
Dabei sind | Dabei sind | ||
* <math>\lambda_{\mathrm{vac}}</math> die [[Wellenlänge]] des Lichts im [[Vakuum]] | * <math>\lambda_{\mathrm{vac}}</math> die [[Wellenlänge]] des Lichts im [[Vakuum]] | ||
* <math>R</math> die Rydberg-Konstante für das jeweilige Element: <math>R = \frac{R_{\infty}}{1+ \frac{ | * <math>R</math> die Rydberg-Konstante für das jeweilige [[Chemisches Element|Element]]: <math>R = \frac{R_{\infty}}{1+ \frac{m_\mathrm e}{M}} </math> mit | ||
** <math> | ** <math>m_\mathrm e</math> die Masse des Elektrons | ||
** <math>M</math> die [[Kernmasse]] (abhängig vom vorliegenden [[Isotop]]) | ** <math>M</math> die [[Kernmasse]] (abhängig vom vorliegenden [[Isotop]]) | ||
** <math>R_\infty</math> die [[Rydberg-Konstante]] für unendliche Kernmasse | ** <math>R_\infty</math> die [[Rydberg-Konstante]] für unendliche Kernmasse. Da | ||
* <math>n_1</math> und <math>n_2</math> ganzzahlige Werte der [[Hauptquantenzahl]] (mit <math>n_1 < n_2</math>): <math>n_2</math> ist die Quantenzahl des Orbits, von dem aus das Elektron in den tiefer gelegenen Orbit <math>n_1</math> übergeht | ::<math>\begin{align} | ||
m_\mathrm e &\ll M_\mathrm{min} = m_\mathrm{proton}\ (\mathrm{Faktor} < 0{,}00055)\\ | |||
\Rightarrow \frac{m_\mathrm e} M &\ll 1\\ | |||
\Rightarrow 1 + \frac{m_\mathrm e} M &\approx 1\\ | |||
\Rightarrow R &\approx R_{\infty} | |||
\end{align}</math> | |||
* <math>n_1</math> und <math>n_2</math> ganzzahlige Werte der [[Hauptquantenzahl]] (mit <math>n_1 < n_2</math>): <math>n_2</math> ist die Quantenzahl des Orbits, von dem aus das Elektron in den tiefer gelegenen Orbit <math>n_1</math> übergeht – also etwa vom dritten Orbit <math>n_2 = 3</math> in den zweiten <math>n_1 = 2</math> (siehe [[Bohrsches Atommodell]]). | |||
=== Energie | === Energie === | ||
Für die Energie des emittierten [[Photon]]s | Für die Energie des emittierten [[Photon]]s gilt: | ||
:<math>E = \frac{1}{\lambda_{\mathrm{vac}}} \cdot c \cdot h</math> | :<math>E = \frac{1}{\lambda_{\mathrm{vac}}} \cdot c \cdot h</math> | ||
| Zeile 24: | Zeile 33: | ||
* [[Plancksche Konstante|Planckscher Konstante]] <math>h</math>. | * [[Plancksche Konstante|Planckscher Konstante]] <math>h</math>. | ||
Entsprechend gilt für die Energiestufen der beiden o. g. Orbits im Atom (siehe [[Rydberg-Energie #Anwendung|Rydberg-Energie]]): | |||
: <math>E_1 = \frac R {n_1^2} \cdot c \cdot h</math> | |||
: <math>E_2 = \frac R {n_2^2} \cdot c \cdot h</math>. | |||
Mit <math>n_1 < n_2</math> folgt daraus: | |||
: <math>\Rightarrow E_1 > E_2</math>. | |||
Nachdem die Bedeutung der Hauptquantenzahl <math>n</math> im [[Term]] <math>\tfrac R {n^2}</math> für die Energieniveaus erkannt worden war, bürgerten sich die Begriffe [[Termsymbol]] und [[Termschema]] für damit zusammenhängende Werkzeuge ein. | |||
=== Spektrallinien-Serien === | |||
Mit <math>n_1 = 1</math> ([[Grundzustand]]) und <math>n_2 \in (2..\infty)</math> erhält man eine Serie von [[Spektrallinie]]n, die auch [[Lyman-Serie]] genannt wird. Der erste Übergang der Serie hat eine Wellenlänge von 121 nm, die Seriengrenze liegt bei 91 nm. Analog ergeben sich die anderen Serien: | Mit <math>n_1 = 1</math> ([[Grundzustand]]) und <math>n_2 \in (2..\infty)</math> erhält man eine Serie von [[Spektrallinie]]n, die auch [[Lyman-Serie]] genannt wird. Der erste Übergang der Serie hat eine Wellenlänge von 121 nm, die Seriengrenze liegt bei 91 nm. Analog ergeben sich die anderen Serien: | ||
[[Datei:Spectral lines of the hydrogen atom.svg|350px|mini|Energieniveaus des Wasserstoffspektrums]] | [[Datei:Spectral lines of the hydrogen atom.svg|350px|mini|Energieniveaus des Wasserstoffspektrums]] | ||
| Zeile 37: | Zeile 58: | ||
| 2 bis ∞ | | 2 bis ∞ | ||
| [[Lyman-Serie]] | | [[Lyman-Serie]] | ||
| | |style="text-align:right"| 121 nm | ||
| | |style="text-align:right"| 91,13 nm | ||
|- | |- | ||
| 2 | | 2 | ||
| 3 bis ∞ | | 3 bis ∞ | ||
| [[Balmer-Serie]] | | [[Balmer-Serie]] | ||
| | |style="text-align:right"| 656 nm | ||
| | |style="text-align:right"| 364,51 nm | ||
|- | |- | ||
| 3 | | 3 | ||
| 4 bis ∞ | | 4 bis ∞ | ||
| [[Paschen-Serie]] | | [[Paschen-Serie]] | ||
| | |style="text-align:right"| 1.874 nm | ||
| | |style="text-align:right"| 820,14 nm | ||
|- | |- | ||
| 4 | | 4 | ||
| 5 bis ∞ | | 5 bis ∞ | ||
| [[Brackett-Serie]] | | [[Brackett-Serie]] | ||
| | |style="text-align:right"| 4.051 nm | ||
| | |style="text-align:right"| 1458,03 nm | ||
|- | |- | ||
| 5 | | 5 | ||
| 6 bis ∞ | | 6 bis ∞ | ||
| [[Pfund-Serie]] | | [[Pfund-Serie]] | ||
| | |style="text-align:right"| 7.456 nm | ||
| | |style="text-align:right"| 2278,17 nm | ||
|- | |- | ||
| 6 | | 6 | ||
| 7 bis ∞ | | 7 bis ∞ | ||
| [[ | | [[Humphreys-Serie]] | ||
| | |style="text-align:right"| 12.365 nm | ||
| | |style="text-align:right"| 3280,56 nm | ||
|} | |} | ||
<div style="clear:both;"></div> | <div style="clear:both;"></div> | ||
== | == Erweiterungen == | ||
Für [[Wasserstoffähnliches Ion|wasserstoffähnliche Ionen]], d.h. Ionen, die nur ein Elektron besitzen, wie z. B. He<sup>+</sup>, Li<sup>2+</sup>, Be<sup>3+</sup> oder Na<sup>10+</sup>, lässt sich obige Formel erweitern zu: | === Für wasserstoffähnliche Atome === | ||
Für [[Wasserstoffähnliches Ion|wasserstoffähnliche Ionen]], d. h. Ionen, die nur ein einziges Elektron besitzen, wie z. B. He<sup>+</sup>, Li<sup>2+</sup>, Be<sup>3+</sup> oder Na<sup>10+</sup>, lässt sich obige Formel erweitern zu: | |||
:<math>\frac{1}{\lambda_{\mathrm{vac}}} = Z^2 R \left( \frac{1}{{n'}_1^2} - \frac{1}{{n'}_2^2} \right)</math> | : <math>\frac{1}{\lambda_{\mathrm{vac}}} = Z^2 R \left( \frac{1}{{n'}_1^2} - \frac{1}{{n'}_2^2} \right)</math> | ||
mit der [[Kernladungszahl]] <math>Z</math>, d.h. der Anzahl der [[Proton]]en im [[Atomkern]] | mit | ||
* der [[Kernladungszahl]] <math>Z</math>, d. h. der Anzahl der [[Proton]]en im [[Atomkern]] | |||
* die um den [[Quantendefekttheorie|Quantendefekt]] <math>\delta_n</math> korrigierten [[Effektive Hauptquantenzahl|effektiven Hauptquantenzahlen]] <math>n'_i = n_i - \delta_n</math>. | |||
Eine Verallgemeinerung auf die Lichtemission von Atomen, die ein einzelnes Elektron in | === Für Atome mit einem Valenzelektron === | ||
Eine weitere Verallgemeinerung auf die Lichtemission von Atomen, die in ihrer [[Valenzschale|äußersten Schale]] ein einzelnes Elektron besitzen, darunter aber evtl. weitere Elektronen in [[Oktettregel|abgeschlossenen Schalen]], führt zum [[Moseleysches Gesetz|Moseleyschen Gesetz]]. | |||
== Literatur == | == Literatur == | ||
* | * Joseph Reader, Charles H. Corliss: ''Line Spectra of the Elements''. In: ''[[CRC Handbook of Chemistry and Physics]]'' | ||
== Weblinks == | == Weblinks == | ||
* [http://physics.nist.gov/cgi-bin/ASD/lines1.pl?unit=1&line_out=0&bibrefs=1&show_obs_wl=1&show_calc_wl=1&A_out=1&intens_out=1&allowed_out=1&forbid_out=1&conf_out=1&term_out=1&enrg_out=1&J_out=1&g_out=0&spectra=H%20I Umfangreiche Datenbank mit 568 Emissionslinien des Wasserstoffs] des [[National Institute of Standards and Technology]] ( | * [http://physics.nist.gov/cgi-bin/ASD/lines1.pl?unit=1&line_out=0&bibrefs=1&show_obs_wl=1&show_calc_wl=1&A_out=1&intens_out=1&allowed_out=1&forbid_out=1&conf_out=1&term_out=1&enrg_out=1&J_out=1&g_out=0&spectra=H%20I Umfangreiche Datenbank mit 568 Emissionslinien des Wasserstoffs] des [[National Institute of Standards and Technology]] (A. Kramida, Yu. Ralchenko, J. Reader, and NIST ASD Team (2014). NIST Atomic Spectra Database (ver. 5.2)) | ||
[[Kategorie:Atomphysik]] | [[Kategorie:Atomphysik]] | ||
[[Kategorie:Spektroskopie]] | [[Kategorie:Spektroskopie]] | ||
Aktuelle Version vom 22. Februar 2020, 10:27 Uhr
Die Rydberg-Formel (auch Rydberg-Ritz-Formel) wird in der Atomphysik benutzt, um das Linienspektrum des vom Wasserstoff emittierten Lichtes zu bestimmen. Sie zeigt, dass die Bindungsenergie des Elektrons im Wasserstoffatom umgekehrt proportional zum Quadrat der Hauptquantenzahl ist.
Die Formel wurde am 5. November 1888 vom schwedischen Physiker Johannes Rydberg vorgestellt; auch Walter Ritz arbeitete an ihr.
Korrekturen aufgrund von Drehimpulsen oder relativistischen Effekten werden in der Rydberg-Formel nicht berücksichtigt. Später wurde sie erweitert, um das Spektrum anderer Elemente zu bestimmen (s. u. Erweiterungen).
Rydberg-Formel für Wasserstoff
Formulierung
- $ {\frac {1}{\lambda _{\mathrm {vac} }}}=R\left({\frac {1}{n_{1}^{2}}}-{\frac {1}{n_{2}^{2}}}\right) $
Dabei sind
- $ \lambda _{\mathrm {vac} } $ die Wellenlänge des Lichts im Vakuum
- $ R $ die Rydberg-Konstante für das jeweilige Element: $ R={\frac {R_{\infty }}{1+{\frac {m_{\mathrm {e} }}{M}}}} $ mit
- $ m_{\mathrm {e} } $ die Masse des Elektrons
- $ M $ die Kernmasse (abhängig vom vorliegenden Isotop)
- $ R_{\infty } $ die Rydberg-Konstante für unendliche Kernmasse. Da
- $ {\begin{aligned}m_{\mathrm {e} }&\ll M_{\mathrm {min} }=m_{\mathrm {proton} }\ (\mathrm {Faktor} <0{,}00055)\\\Rightarrow {\frac {m_{\mathrm {e} }}{M}}&\ll 1\\\Rightarrow 1+{\frac {m_{\mathrm {e} }}{M}}&\approx 1\\\Rightarrow R&\approx R_{\infty }\end{aligned}} $
- $ n_{1} $ und $ n_{2} $ ganzzahlige Werte der Hauptquantenzahl (mit $ n_{1}<n_{2} $): $ n_{2} $ ist die Quantenzahl des Orbits, von dem aus das Elektron in den tiefer gelegenen Orbit $ n_{1} $ übergeht – also etwa vom dritten Orbit $ n_{2}=3 $ in den zweiten $ n_{1}=2 $ (siehe Bohrsches Atommodell).
Energie
Für die Energie des emittierten Photons gilt:
- $ E={\frac {1}{\lambda _{\mathrm {vac} }}}\cdot c\cdot h $
mit
- Lichtgeschwindigkeit $ c $ im Vakuum
- Planckscher Konstante $ h $.
Entsprechend gilt für die Energiestufen der beiden o. g. Orbits im Atom (siehe Rydberg-Energie):
- $ E_{1}={\frac {R}{n_{1}^{2}}}\cdot c\cdot h $
- $ E_{2}={\frac {R}{n_{2}^{2}}}\cdot c\cdot h $.
Mit $ n_{1}<n_{2} $ folgt daraus:
- $ \Rightarrow E_{1}>E_{2} $.
Nachdem die Bedeutung der Hauptquantenzahl $ n $ im Term $ {\tfrac {R}{n^{2}}} $ für die Energieniveaus erkannt worden war, bürgerten sich die Begriffe Termsymbol und Termschema für damit zusammenhängende Werkzeuge ein.
Spektrallinien-Serien
Mit $ n_{1}=1 $ (Grundzustand) und $ n_{2}\in (2..\infty ) $ erhält man eine Serie von Spektrallinien, die auch Lyman-Serie genannt wird. Der erste Übergang der Serie hat eine Wellenlänge von 121 nm, die Seriengrenze liegt bei 91 nm. Analog ergeben sich die anderen Serien:
| $ n_{1} $ | $ n_{2} $ | Name | Wellenlänge des ersten Übergangs (α-Linie) |
konvergiert gegen Seriengrenze |
|---|---|---|---|---|
| 1 | 2 bis ∞ | Lyman-Serie | 121 nm | 91,13 nm |
| 2 | 3 bis ∞ | Balmer-Serie | 656 nm | 364,51 nm |
| 3 | 4 bis ∞ | Paschen-Serie | 1.874 nm | 820,14 nm |
| 4 | 5 bis ∞ | Brackett-Serie | 4.051 nm | 1458,03 nm |
| 5 | 6 bis ∞ | Pfund-Serie | 7.456 nm | 2278,17 nm |
| 6 | 7 bis ∞ | Humphreys-Serie | 12.365 nm | 3280,56 nm |
Erweiterungen
Für wasserstoffähnliche Atome
Für wasserstoffähnliche Ionen, d. h. Ionen, die nur ein einziges Elektron besitzen, wie z. B. He+, Li2+, Be3+ oder Na10+, lässt sich obige Formel erweitern zu:
- $ {\frac {1}{\lambda _{\mathrm {vac} }}}=Z^{2}R\left({\frac {1}{{n'}_{1}^{2}}}-{\frac {1}{{n'}_{2}^{2}}}\right) $
mit
- der Kernladungszahl $ Z $, d. h. der Anzahl der Protonen im Atomkern
- die um den Quantendefekt $ \delta _{n} $ korrigierten effektiven Hauptquantenzahlen $ n'_{i}=n_{i}-\delta _{n} $.
Für Atome mit einem Valenzelektron
Eine weitere Verallgemeinerung auf die Lichtemission von Atomen, die in ihrer äußersten Schale ein einzelnes Elektron besitzen, darunter aber evtl. weitere Elektronen in abgeschlossenen Schalen, führt zum Moseleyschen Gesetz.
Literatur
- Joseph Reader, Charles H. Corliss: Line Spectra of the Elements. In: CRC Handbook of Chemistry and Physics
Weblinks
- Umfangreiche Datenbank mit 568 Emissionslinien des Wasserstoffs des National Institute of Standards and Technology (A. Kramida, Yu. Ralchenko, J. Reader, and NIST ASD Team (2014). NIST Atomic Spectra Database (ver. 5.2))